Предложен новый подход к подавлению роста опухолей
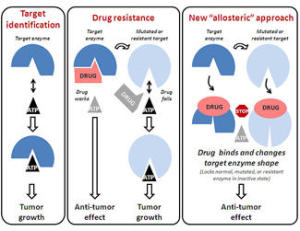 Суть предложенного учёными «аллостерического» подхода. |
|
||||||||
Группа учёных, которую возглавил профессор Дэвид Чериш (David A. Cheresh), использовала современные химико-биологические подходы для создания нового класса лекарственных препаратов. Представители данного класса, связываясь с молекулами фермента под названием RAF и меняя его конформацию, запрещают деление практически всех опухолевых клеток.
К настоящему времени биологи собрали немало информации о белке RAF. Однако его участие в клеточном делении стало сюрпризом для учёных. Напомним, принято считать, что утрата способности контролировать процесс клеточного деления приводит к быстрому росту опухолевых тканей. «С помощью создания нового класса соединений, меняющих конформацию RAF, мы смогли получить ранее неизвестную информацию о функциях данного белка» - говорит профессор Чериш.
Существующие лекарственные средства, которые подавляют активность ферментных молекул, подобных RAF, разработаны так, чтобы оказывать влияние на активные центры ферментов. По словам профессора Чериша, данные препараты не обладают необходимой специфичностью. «Они поражают большое количество различных мишеней. Это значит, что они могут приводить к возникновению побочных эффектов» - говорит Дэвид Чериш. Токсичность таких лекарственных препаратов зависит от используемой дозы. Так же обеспокоенность вызывает тот факт, что опухолевые клетки приобретают устойчивость к действию таких лекарственных препаратов.
Профессор Чериш и его коллеги решили разработать новый класс лекарственных препаратов, подавляющих активность RAF, не связываясь с активными сайтами фермента. Так учёные решили обойти ограничения, которые отмечаются у современных лекарственных препаратов. Авторы пытались создать класс соединений (аллостерических ингибиторов), которые бы меняли конформацию целевого фермента, делая его неактивным. Учёные протестировали действие определённого препарата, известного как KG5. Данный препарат изолирует белок RAF в пролиферирующих клетках и не оказывает влияния на RAF покоящихся клеток. В опухолевых клетках [после влияния KG5] RAF не имел возможности связываться с митотическим аппаратом, что было необходимо для клеточного деления. Результатом этого была запрограммированная клеточная гибель (апоптоз). KG5 похожим образом препятствует протеканию ангиогенеза.
«Это необычное исследование, результаты которого могут изменить ряд устоявшихся мнений. До создания данного препарата мы и не предполагали, что RAF может способствовать развитию опухолевых клеток. Это лишь только один пример того, как с помощью создания лекарственных препаратов, избегающих влияния на активные сайты ферментов, мы можем определить новые, неожиданные пути подавления роста опухолей. По сути, мы оказываем определённое влияние на важные ферментные молекулы абсолютно по-новому и тем самым узнаём новые факты о функциях данных молекул» - говорит профессор Чериш.
Аналогичные результаты действия KG5 были получены при тестировании на различных линиях раковых клеток, на животных и на раковых клетках, взятых при биопсии из человеческого организма. С момента получения данных результатов учёные успели разработать несколько вариантов KG5, которые обладают в 100 раз более высокой активностью по сравнению с оригинальным препаратом. Учёные планируют проверить один из этих вариантов в рамках проведения клинических испытаний.
Результаты проведённого исследования можно найти на интернет-страницах журнала Nature Medicine.
Также по теме:
- Обнаружена мишень, которая может быть использована для замедления развития рака молочной железы
- Получены новые данные об альтернативном удлинении теломер
Источники: