Новая химическая связь
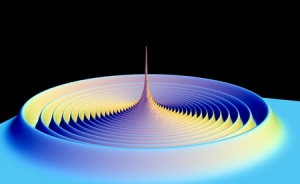 На этом графике изображены вероятности нахождения электрона на разном расстоянии от ядра в возбужденном состоянии рубидия. В молекуле, невозбужденный атом застревает в одном из внешних колец. (Credit: Vera Bendkowsky/University of Stuttgart) (кликните картинку для увеличения) |
|
||||||||
Связывание двух атомов в единую молекулу – это как зачатие ребенка: существует не очень-то много вариантов осуществления задуманного. При первых двух стратегиях, два атома соединяются, когда их орбитали – похожие на облако распределения электронов, парящих вокруг атомного ядра – перекрываются и сливаются так, что атомы разделяют один или более электронов между собой. Если при этом участвуют атомы одного и того же элемента, то они поделят электрон поровну, образуя так называемую ковалентную связь. Если атомы разные, например натрий и хлор, то один из них перетягивает электрон на свою сторону, и такая связь называется ионной. Третий тип называется Ван-дер-Ваальсовой связью, когда атомы в принципе не делятся электронами; вместо этого, при небольших флуктуациях один из атомов обретает ненадолго более положительный заряд, чем другой. Такие быстрые «поляризации» порождают сходные флуктуации в других атомах, что и удерживает их вместе.
Вера Бендковски (Vera Bendkowsky), Тильман Пфау (Tilman Pfau) и их коллеги из университета Штудгарда в Германии показали четвертый вариант связывания двух атомов. Ученые начали с низкотемпературного газа атомов рубидия. Используя точно настроенный лазер, они «возбудили» электроны в некоторых атомах до высокоэнергетических орбиталей. Эти орбитали настолько большие, что электрон летает на расстоянии почти в 100 нанометров от ядра, что в 400 раз превышает радиус нормального атома рубидия. Если другой невозбужденный атом рубидия случайно окажется рядом, то он может связаться с возбужденным, образуя гигантскую двухатомную молекулу, которая может быть больше даже некоторых вирусов.
Это происходит потому, что далеко летающий электрон возбужденного атома сталкивается с невозбужденным атомом снова и снова, каждый раз его понемногу подтягивая. На самом деле, благодаря квантовой неопределенности, электрон находится в любой точке своей орбитали в любое время, таким образом, он непрерывно сталкивается с невозбужденным атомом. Это равносильно легким толчкам, которые не позволяют невозбужденному атому далеко уплыть. Это создает очень слабую связь, которая держится до тех пор, пока возбужденный атом не потеряет свою дополнительную энергию. Об этом исследователи доложили в Nature. Так как атомы рубидия не имеют общей орбитали и не поляризуют друг друга, то это взаимодействие можно назвать новым типом химической связи.
Существование таких молекул было предсказано в 2000 году теоретиком Крисом Грином (Chris Greene) из Объединенного института астрофизических лабораторий (JILA). «Это очень приятно получить подтверждение и знать, что теперь люди воспримут твой (теоретический) подход серьезнее», говорит Грин. Молекулы с необычными формами могут быть так же образованы возбужденными атомами, но чуть более сложными механизмами. Но Бендковски говорит: «Я не могу предположить ни одного применения, где бы вы могли построить что-нибудь из этих молекул. Это только лишь фундаментальная физика».
Также по теме:
Источники:
- V. Bendkowsky, B. Butscher, J. Nipper, J.P. Shaffer, R. Löw & T. Pfau 2009, Observation of ultralong-range Rydberg molecules, Nature 458, 1005-1008