Нанотрубки позволяют наблюдать за активностью ферментов
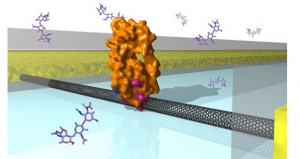 Трехмерная модель устройства, состоящего из биологической молекулы и углеродной нанотрубки, закрепленной на подложке. (кликните картинку для увеличения) |
|
||||||||
Несмотря на высокий уровень развития технологий, ученые все еще не могут до конца проникнуть в природу сложных биологических молекул и того, как они взаимодействуют с окружающей средой. Белки, например, склонны изгибаться вокруг длинных цепочек аминокислот и ферментов, в частности, меняют форму, когда связываются с субстратом. Часто эти изменения формы имеют критическое значение для того, каким образом молекулы функционируют. Хотя поведение белковых молекул можно до определенной степени контролировать, до сих пор не существует способа отслеживать поведение молекулы белка в течение длительного промежутка времени.
Новая техника, предложенная группой ученых из University of California (США) могла бы в будущем заполнить эту нишу. В рамках своей работы исследователи показали, что при помощи новой методики они могут наблюдать изменения формы молекулы лизоцима, присоединив ее к полевому транзистору, построенному на базе углеродной нанотрубки.
В природе молекулы лизоцима можно найти в слюне и слезах, а также среди других биологических жидкостей. Лизоцим помогает уничтожать вредные бактерии в организме за счет разрушения клеточной мембраны микроорганизмов. Лизоцим отличается очень малым размером молекул (5 – 7 нм, что примерно в 100 раз меньше длины волны света). Таким образом, молекулу лизоцима невозможно «увидеть» с помощью оптического микроскопа.
Свой эксперимент группа ученых начала с присоединения молекулы лизоцима к транзистору на базе углеродной нанотрубки с помощью химической реакции. Затем они наблюдали ток, протекающий через полученное устройство при комнатной температуре в соляном растворе, содержащем различные виды бактерий. Когда молекула лизоцима начинает взаимодействовать с бактериями, изменяется ее форма, т.е. появляется движение. Эти изменения неизбежно влияют на ток, проходящий через транзистор, позволяя ученым фиксировать происходящее.
Эксперимент показал, что в отсутствии бактерий в соляном растворе ток, проходящий через «модифицированный» транзистор, не изменяется. Но когда появляются бактерии, эксперимент позволяет зафиксировать два типа сигналов (в зависимости от «скорости» работы фермента).
Благодаря проведенному эксперименту, исследователи почерпнули важную информацию о лизоциме и его функциях, в частности, теперь они лучше понимают, как фермент может изменять «скорость» своей работы и постоянно обеспечивать разрушение клеточных мембран бактерий. Но наиболее важным аспектом работы является тот факт, что ученые продемонстрировали новый подход к изучению биологических молекул. Они смогли наблюдать химию в действии с молекулярной чувствительностью. На сегодняшний день предложенная техника позволяет производить наиболее длительную запись деятельности одной молекулы.
Имея новый метод исследований, ученые уже сейчас могут перейти к изучению других белков. Они считают, что аналогичный подход может быть применен для исследования молекул, ответственных за определенные заболевания, а также тех, которые могут показать качество разрабатываемых лекарств.
Подробные результаты работы опубликованы в журнале Science.
Также по теме:
- Могут ли углеродные нанотрубки помочь с удалением холестерина?
- Связки нанотрубок могут найти применение в солнечных элементах
Источники: