Расширены представления об инъекции бактериотоксинов
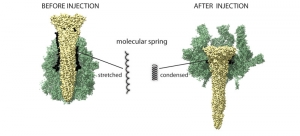 На рисунке отображены структурные изменения ТсА при инъецировании. Токсин активируется изменением рН. В результате наружная оболочка (зелёная) открывается, и растянутая молекулярная пружина может сократиться. Таким образом она проталкивает центральный канал (жёлтый) вместе со своим сокращением. (кликните картинку для увеличения) |
|
||||||||
Photorhabdus luminescens — это симбионт, который сосуществует с круглыми червями. Данные бактерии покоятся в кишечнике червей, дожидаясь возможности атаковать организм насекомых. Когда они попадают в целевой организм, то становятся более активными, выделяя токсиновые комплексы, убивающие насекомых. После круглые черви используют труп насекомого, сосуществуя вместе с бактериями в ожидании следующей жертвы.
«До настоящего момента времени о структуре токсиновых комплексов нам было известно немного. У нас была лишь общая модель. Теперь же у нас есть изображения, которые позволяют дифференцировать отдельные атомы! Вероятно, не существует другого изображения белкового канала, на котором вы можете разглядеть белок в данном канале» — говорит Стефан Раунсер. Получить детальные изображения удалось благодаря использованию рентгеноструктурного анализа и электронной криомикроскопии.
Токсиновые трёхсоставные комплексы (Тс-комплексы) образованы тремя субъединицами: ТсА, ТсВ и ТсС. ТсА формирует канал, который проникает через клеточную мембрану наподобие укола и запасает токсичный энзим в клетке. Ранее было непонятно, откуда на данный процесс берётся энергия.
«ТсА имеет белковую цепь, построенную 48-ю аминокислотами. Она растягивается как резинка для волос или пружина» — говорит Стефан Раунсер. Если данная белковая цепь сокращается, то выделяется энергия, которая обеспечивает проталкивание канала через мембрану. Данный механизм позволяет отделять Тс-комплексы от других известных пороформирующих инъецирующих белков, тех, например, что встречаются у дифтерийных бактерий и бактерий сибирской язвы.
Субъединица ТсА ответственна и за связывание токсинового комплекса с клетками организма хозяина. Для этого она может использовать 20 рецептор-связывающих доменов. «Мы считаем, что четыре домена из этого числа всегда окружают один рецептор, таким образом увеличивая силу связывания» — уточняет Раунсер.
Данные рецептор-связывающие домены могут быть легко удалены или заменены другими доменами. Это значит, что Тс-комплексы могут быть использованы против определённых групп клеток, например, опухолевых. Предполагается, что они смогут «впрыскивать» в целевые клетки лекарственные соединения. Тс-комплексы патогенов насекомых могут так же использоваться в качестве пестицидов в сельском хозяйстве.
Более подробное описание результатов проведённого исследования можно найти в журнале Nature.
Также по теме:
- Гибель изнутри: описан неизвестный ранее механизм гибели бактериальных клеток
- Бактериальные токсины можно использовать против самих бактерий
- Ядовитые пауки и моллюски помогают нейробиологам изучать функционирование ионных каналов
- Уровень рН влияет на степень токсичности водорослей
- Американский лесной хомяк питается ядовитыми кустарниками уже многие тысячелетия
Источники: