Молекулярный зонд и спектроскопия позволяют более детально отследить изменения химических связей в белковых молекулах
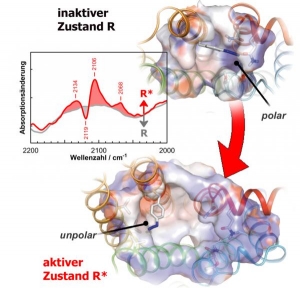 Спектр «азидозонда» (выделен на рисунке синим цветом) позволяет биофизикам детально проанализировать изменения, протекающие во время отдельных стадий активации рецепторов. (кликните картинку для увеличения) |
|
||||||||
Международной группе учёных, в состав которой вошли Райнер Вогель и Екатерина Зайцева (Reiner Vogel & Ekaterina Zaitseva, биофизики института молекулярной медицины и клеточной биологии при университете Фрайбурга), Шиксинь Йе и Томас Сакмар (Shixin Ye and Thomas P. Sakmar, биофизики из Нью-Йорка) и Ксавье Дюпи (Xavier Deupi, биофизик из Барселоны), удалось ввести молекулярный зонд в белковую молекулу. С помощью спектроскопии и данного зонда исследователи смогли отследить изменения, которые произошли с данной молекулой. Поскольку белки нашего организма по своей химической природе - это совокупности аминокислот, то группа учёных решила использовать в качестве зонда п-азидо-фенилаланин. Учёные проверили эффективность работы зонда, использовав родопсин (мембранный белок светочувствительных клеток сетчатки глаза).
После того, как родопсин поглощает квант света, он проходит серию превращений, образуя промежуточные формы, так называемые интермедиаты (продукты превращения родопсина, вызванные поглощением кванта света). По окончании серии превращений родопсина происходит активация последующих элементов цепи передачи сигнала, вызванного поглощением кванта света. Использование п-азидо-фенилаланина позволило учёным более детально (чем когда-либо ранее) изучить интермедиаты, образующиеся в ходе ряда превращений молекулы родопсина. По мнению авторов исследований, полученные ими результаты способны внести серьёзный вклад в изучение процессов активации различных рецепторов.
Более подробные результаты исследований опубликованы в журнале «Nature».
Также по теме:
Источники: